CLAIMS
- Probiotic mixture comprising, or consisting of, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium and Streptococcus thermofilus.
- Probiotic mixture according to claim 1, wherein facultative aerobic- anaerobic bacteria (Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium and Streptococcus thermofilus) are present at 40 ± 5% and anaerobic bacteria (Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, and Bacillus subtilis) are present at 60 ± 5% of the total colony forming units per gram (ufc x g) of the probiotic mixture.
- Probiotic mixture according to claim 1 or 2, wherein probiotics of the genus Bifidobacterium are present at 50% ± 5%, probiotics of the genus Lactobacillus are present at 16.5% ± 5%, Enterococcus faecium and Streptococcus thermofilus are overall present at 23.5% ± 5% and Bacillus subtilis is present at 10% ± 5% of the total colony forming units per gram (ufc x g) of the probiotic mixture.
- Probiotic mixture according to any one of claims 1 to 3, wherein Bifidobacterium bifidum is present at 12%-14%, preferably at 13.03%; Bifidobacterium breve is present at 11.6%-13.1%, preferably at 12.3%; Bifidobacterium longum, is present at 22.8%-25.5%, preferably at 24.19%; Bacillus subtilis, is present at 9.6%-10.7%, preferably at 10.1%; Lactobacillus casei is present at 5.2%-6.9%, preferably at 6.1%; Lactobacillus gasseri is present at 3.9%-4.2%, preferably at 4.1%; Lactobacillus rhamnosus is present at 5.2%-6.9%, preferably at 6.1%; Enterococcus faecium is present at 11.4%-12.5%, preferably at 12.04 % e Streptococcus thermofilus is present at 11.4%-12.5%, preferably at 12.04% of the total colony forming units of the probiotic mixture.
- Probiotic mixture according to any one of claims 1 to 4 for use as a medicament.
- Probiotic mixture for use according to claim 5, for use in the prevention and/or treatment of intestinal diseases preferably selected among infectious and antibiotic therapy-associated diarrhoeas, preferably by Clostridium difficile, and associated intestinal dysbiosis.
- Composition comprising the mixture as defined in any one of claims 1 to 4 and at least a suitable excipient and/or additive.
- Composition according to claim 7 for oral use.
- Composition according to claim 8 in solid, semisolid, liquid or semiliquid form.
- Composition according to claim 9 in form of a tablet, hard or soft capsule, pill, gelatine, lozenge, powder, granules, sachet, film, drops, suspension, emulsion, solution, syrup or elixir.
- Composition according to claim 10 in form of a gastro-resistant tablet or capsule.
- Composition according to any one of claims 7 to 11 for use as a medicament.
- Composition for use according to claim 12, for use in the prevention and/or treatment of intestinal diseases preferably selected among infectious and antibiotic therapy-associated diarrhoeas, preferably by Clostridium difficile, and associated intestinal dysbiosis.
- Food product selected among a food supplement, beverage, nutraceutical, aliment and functional or medicated aliment comprising the mixture according to any one of claims 1 to 4 and at least a suitable excipient and/or additive.
- Food product according to claim 14 in form of a yogurt, juice, smoothie, extract, extracted juice, food bar or gelatine.
“Consorzio di probiotici”
DESCRIZIONE
STATO DELLA TECNICA ANTERIORE
L’infezione da Clostridium difficile (CDI), un batterio anaerobio sporigeno, può causare diarrea e colite con complicanze severe come megacolon, perforazione intestinale, shock e morte. La colonizzazione intestinale avviene per via oro-fecale ed è favorita dalla modifica della flora intestinale a seguito di una precedente terapia antibiotica. Dopo la colonizzazione, CD produce tossine (A e B) che si legano a recettori delle cellule della mucosa intestinale determinando flogosi e diarrea. Gli individui degenti, soprattutto dai 65 anni di età, in ambienti ospedalieri, sono particolarmente esposti all’infezione da CD. Il trattamento standard, pur efficace, non elimina il rischio di un alto tasso di ricorrenza dell’infezione (pari al 35% di cui il 40-45% va incontro ad una seconda ricorrenza; dopo 2 o 3 ricorrenze, il 60-65% dei pazienti sperimenta ricorrenze multiple), intendendo per “ricorrenza” la ricomparsa dei sintomi e la positività della tossina nelle feci entro un mese dalla fine del trattamento, a causa della persistenza di spore o di reinfezione. Nell’ultima decade, le problematiche legate all’infezione da CD sono aumentate a causa di una maggiore diffusione in ambito nosocomiale e della comparsa di nuovi ceppi più virulenti.
Il trattamento standard di prima linea contempla la possibilità di utilizzare la vancomicina o il metronidazolo con un tasso di eradicazione del 97-87%, rispettivamente. Tuttavia, dopo un iniziale successo terapeutico, fino al 35% di tutti i pazienti trattati vanno incontro ad una prima ricorrenza dell’infezione, come conseguenza di persistenza di spore o di reinfezione. Per trattare la CDI ricorrente sono stati introdotti nuovi approcci terapeutici che prevedono l’impiego della rifaximina, della nitazoxanide, oppure della fidaxomicina.
Tuttavia, in un‘epoca di “antibiotic stewardship”, ossia un insieme di azioni coerenti che promuovono l’uso responsabile degli antibiotici, è sempre più sentita la necessità di mezzi alternativi agli antibiotici nel trattamento e nella prevenzione di patogeni infettivi, al fine di evitare lo sviluppo di germi multiresistenti diffusibili.
A tal fine, sono state sperimentate terapie immunologiche quali la somministrazione endovenosa di immunoglobuline oppure di anticorpi monoclonali specifici contro la tossina del Clostridium difficile (CD).
Inoltre, contro l’infezione da C. difficile è risultato molto utile e risolutivo il trapianto di microbiota intestinale (o trapianto fecale) ottenuto da donatore sano che ha consentito di ottenere un calo dei decessi e di interventi chirurgici di coloresezione.
Tale tecnica è nota in letteratura sin dal 1958 e da allora un numero sempre maggiore di evidenze ha dimostrato l’efficacia del trapianto fecale nel trattamento dell’infezione ricorrente da CD tanto che detta procedura è stata inserita nelle linee guida statunitensi ed europee come opzione terapeutica per il trattamento della CDI (Surawicz et al. – Am J Gsatroenterol 2013; Debast et al. – Clin Infect Dis 2014) ed è stata validata dal Centro Nazionale Trapianti italiano, con numerosi livelli di attenzione e limitazioni strutturali. Sebbene il meccanismo d’azione del trapianto fecale sia ancora poco chiaro, è plausibile che la ricostituzione e la funzione del microbiota intestinale sia di primaria importanza, in quanto costituisce un fattore di resistenza decisivo contro il CD ed altri patogeni, attraverso meccanismi che includono la resistenza alla colonizzazione batterica e la stimolazione del sistema immunitario intestinale. In particolare, la resistenza alla colonizzazione dei patogeni include la produzione di fattori antimicrobici e la competizione per nutrienti e per siti di recettoriali sull’epitelio da parte del microbiota residente. Quest’ultimo “istruisce” ed “innesca” la risposta immunitaria mucosale necessaria al mantenimento dell’omeostasi del microbiota commensale, eliminando i patogeni dannosi. La distruzione della normale flora microbica intestinale, anche conosciuta come disbiosi, può essere causata da patogeni infettivi e dall’uso di antibiotici, come accade in pazienti affetti da CDI.
Cammarota G., Masucci L. et al. (“Randomised clinical trial: faecal microbiota transplantation by colonoscopy vs. vancomycin for the treatment of recurrent Clostridium difficile infection”, Aliment Pharmacol Ther. 2015 May;41(9):835-43.) hanno documentato l’efficacia di tale approccio nel 2015 in un trial clinico randomizzato controllato che metteva a confronto il trapianto fecale per via colonscopica (20 pazienti) con la terapia antibiotica standard con vancomicina (19 pazienti) in pazienti con infezione ricorrente da CD, con risultati rispettivamente del 90% e del 26% di eradicazione dell’infezione. Durante l’attività clinica di trapianto di microbiota intestinale per infezione ricorrente da CD, condotta da Cammarota e Masucci, sono state isolate e coltivate numerose specie batteriche a partire dalle feci di donatori che hanno effettuato pregresse donazioni di feci per trapianto di microbiota intestinale con esito andato a buon fine.
Tra queste, ne sono state selezionate 15 per la formulazione di un “consorzio” batterico. I 15 ceppi sono stati selezionati valutando anche la sensibilità agli antibiotici, mediante test di riferimento internazionali e certificati, al fine di evitare di infondere nei pazienti riceventi eventuali microrganismi Multi-Drugs-Resistence.
Inoltre, ulteriori studi hanno dimostrato la stabilità di alcune specie batteriche (Bifidobacterium genus, Bacteroides e gruppi coccoidi del Clostridium) fino a sei mesi dal trapianto di feci.
Tuttavia, il trapianto fecale presenta diversi svantaggi. Infatti, per stabilirne l’idoneità, il donatore deve essere sottoposto ad una serie di indagini di screening sovrapponibili a quelli effettuati per un donatore di sangue o d’organo, al fine di garantire la non trasmissibilità di eventuali patogeni al ricevente. Ciò, ovviamente, comporta un allungamento nella tempistica e costi notevoli. Negli studi finora pubblicati, sono stati usati metodi di infusione di microbiota differenti che variavano dall’infusione delle feci nel duodeno attraverso un sondino naso- gastrico-duodenale, alla colonscopia, ai clisteri fecali, tutte manovre invasive con necessità di presidi medici e di ricovero in ambiente ospedaliero. Inoltre, la preparazione dell’infusione richiede l’operatività di un laboratorista esperto, preferibilmente, un microbiologo. Oltre a ciò, una volta considerato idoneo il donatore, il giorno della donazione il trattamento delle feci donate deve essere finalizzato entro sei ore e deve nuovamente essere analizzato con test molecolari rapidi per l’esclusione di eventuali patogeni sopraggiunti negli ultimi giorni. Detti test comunque non possono escludere a priori la presenza di patogeni opportunisti multiresistenti.
Pertanto, ad oggi questa pratica risolutiva e salvavita, che non prevede l’utilizzo di antibiotici, è poco diffusa, proprio per la sua scarsa riproducibilità, la necessità di facilities quali un laboratorio di microbiologia, di un servizio di endoscopia adeguati, di personale esperto, di reparti atti a gestire pazienti complessi e fragili ecc.
Ciò ha comunque posto le basi per studi successivi al fine di approfondire la tecnica su modelli animali, in cui è stato identificato un “consorzio” di batteri benefici, isolati da animali sani, che si è dimostrato efficace al pari del trapianto fecale nella guarigione di topi affetti da disbiosi (Li M, et al. “Fecal microbiota transplantation and bacterial consortium transplantation have comparable effects on the re-establishment of mucosal barrier function in mice with intestinal dysbiosis”, Front Microbiol. 2015 Jul 7;6:692). Si è pensato dunque che l’identificazione e la successiva somministrazione di un “consorzio” di batteri benefici potesse rendere significativamente più riproducibile la tecnica del trapianto di microbiota intestinale. Il documento più rilevante e “pioneristico” su tale approccio, è Petrof et al. “Stool substitute transplant therapy for the eradication of Clostridium difficile infection”, Microbiome. Jan 9;1(1):3. Nel 2013, questi ricercatori hanno trattato due pazienti affetti da CDI con un consorzio batterico composto da 33 ceppi ottenuti da pazienti donatori, con risoluzione della sintomatologia ed un dimostrato riequilibrio del microbiota intestinale dei malati.
L’utilizzo di probiotici, in pazienti che cominciano una terapia antibiotica, per la prevenzione di insorgenza di CDI è documentata in letteratura. I risultati ottenuti indicano una riduzione del 60,5% (59,5% negli adulti; 69,4% nei bambini; 61% in pazienti ospedalizzati; 69,4% in pazienti non ricoverati) dell’incidenza di infezioni associate a CD. Tuttavia, sono stati ottenuti risultati contrastanti e non esistono trial clinici con standardizzazione della posologia e dei ceppi probiotici utilizzati. (Lau CS, Chamberlain RS. “Probiotics are effective at preventing Clostridium difficile-associated diarrhea: a systematic review and meta-analysis”. Int J Gen Med. 2016 Feb 22;9:27-37.). Già dal 2008 durante YALE UNVERSITY WORKSHOP on PROBIOTIC RECOMMENDATIONS emerse che tutti gli studi con esito positivo sull’utilizzo dei probiotici in CDI non supportavano chiare raccomandazioni riguardo a dosaggi specifici ed ai ceppi utilizzati. Dal punto di vista commerciale, quindi, non esistono formulazioni strutturate per il trattamento e la prevenzione di CDI. (Spinler JK, Ross CL, Savidge TC.Probiotics as adjunctive therapy for preventing Clostridium difficile infection – What are we waiting for? Anaerobe. 2016 Oct;41:51-57. doi: 10.1016/j.anaerobe.2016.05.007.) Ad oggi, sul mercato esiste solo una formulazione generica che è stata utilizzata, oltre che nella prevenzione, anche nel trattamento CDI, ma comunque non specificamente formulata. (Lifeway kefir) (Bakken JS. Staggered and tapered antibiotic withdrawal with administration of kefir for recurrent Clostridium difficile infection. Clin Infect Dis. 2014 Sep 15;59(6):858-61.
Pertanto, c’è ancora la necessità di sviluppare soluzioni terapeutiche alternative efficaci nella prevenzione e/o nel trattamento di affezioni intestinali quali, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, ad esempio quelle da C. Difficile, o la disbiosi intestinale, che siano riproducibili e in grado di superare gli svantaggi di quelle note nell’arte.
SOMMARIO DELL’INVENZIONE
Gli inventori della presente invenzione hanno ora selezionato specifici microorganismi probiotici, autorizzati dall’EFSA (European Food Safety Authority), realizzando una miscela particolarmente efficace nel ripristino della flora batterica dell’ospite umano, simulante una quota dei batteri intestinali. Tale “consorzio” di probiotici è assumibile per via orale, in quantità tali da poter raggiungere il colon, risolvendo tutte le problematiche sopracitate, associate all’infusione di microbiota intestinale e/o alle composizioni probiotiche note nell’arte.
La presente invenzione riguarda quindi una miscela probiotica comprendente, o costituita da, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus; una composizione comprendente tale miscela e opportuni eccipienti e/o additivi, così come prodotti alimentari comprendenti tale miscela e opportuni eccipienti e/o additivi.
Inoltre, la presente invenzione riguarda anche dette miscele, composizioni e prodotti per l’uso nella prevenzione e/o nel trattamento di affezioni intestinali quali, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, ad esempio quelle da C. difficile, o la disbiosi intestinale e di conseguenza, laddove consentito, un trattamento preventivo e/o terapeutico di affezioni intestinali quali, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, ad esempio quelle da C. difficile, o la disbiosi intestinale comprendente la somministrazione in dosi terapeuticamente efficaci di tale miscela, composizione o prodotto alimentare.
DESCRIZIONE DETTAGLIATA DELLE FIGURE
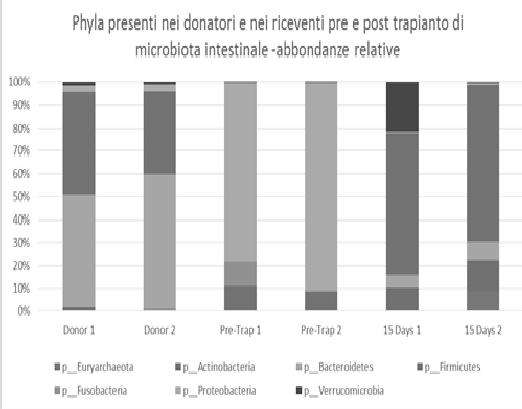
FIG. 1: il grafico mostra l’abbondanza relativa dei phyla presenti nei pazienti donatori e riceventi prima e dopo il trapianto di microbiota intestinale.
FIG. 2: il grafico mostra l’andamento temporale dei Phyla relativi al paziente 1. Prima di ricevere l’infusione (T0) il paziente possedeva un microbiota intestinale a favore del Phylum Bacteroidetes (72%). I Firmicutes ed i Proteobacteria erano presenti con un’abbondanza relativa rispettivamente del 12% e 10%. I Verrucomicrobia erano presenti per lo 0,01%. Al tempo T1 (7 giorni) il livello di Bacteroidetes si riduce al 47% con un aumento di Firmicutes al 23% e Verrucomicrobia al 22%.
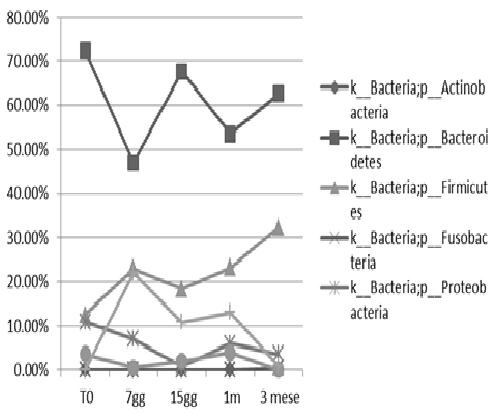
FIG. 3: il grafico mostra l’andamento temporale dei Phyla relativi al paziente 2. Prima di ricevere l’infusione (T0) la popolazione batterica intestinale si presentava costituita da Proteobacteria (60%), Firmicutes (40%) ed una riduzione del Phylum Bacteroidetes (0,05%) e Verrucomicrobia (0,02%). Nei successivi follow-up Proteobacteria raggiungono il 5%, mentre Phylum Bacteroidetes raggiunge il 50% e Verrucomicrobia 17%. Al terzo mese dopo l’infusione il microbiota sembra essere stabile.
GLOSSARIO
Nel contesto della presente descrizione, i termini “probiotici” e “specie probiotiche” hanno il significato comunemente utilizzato in letteratura e indicano, secondo la definizione ufficiale di FAO e OMS, “micro-organismi vivi che, somministrati in quantità adeguata, apportano un beneficio alla salute dell’ospite”.
In particolar modo, nella presente descrizione, questi termini si riferiscono a microorganismi utilizzati come supplemento o complemento alimentare.
Nel contesto della presente descrizione, la dicitura “consorzio di probiotici” è equivalente a “miscela di probiotici” e significa associazione di specifiche specie probiotiche.
Nel contesto della presente descrizione, la dicitura “microbiota intestinale umano” ha il significato comunemente utilizzato in letteratura e significa insieme di microorganismi commensali (ad esempio, batteri, virus, funghi e protozoi intestinali) che convivono con l’organismo umano senza danneggiarlo.
Nel contesto della presente descrizione, il termine “quantità efficace” significa quantità di agente attivo, o di composizione comprendente gli agenti attivi o di prodotto comprendente gli agenti attivi, sufficiente a procurare i benefici desiderati e allo stesso tempo abbastanza bassa da non comportare seri effetti collaterali.
Nel contesto della presente descrizione, “circa” si riferisce all’errore sperimentale che può occorrere durante le misurazioni convenzionali. Più in particolare quando si riferisce ad un valore indica ± 5% del valore indicato e quando riferito ad un intervallo ± 5% degli estremi di questo.
DESCRIZIONE DETTAGLIATA DELL’INVENZIONE
Gli autori della presente invenzione hanno selezionato una miscela probiotica, comprendente Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus particolarmente efficace nella prevenzione e/o nel trattamento di affezioni intestinali quali, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, ad esempio quelle da C. difficile, o la disbiosi intestinale.
Pertanto, la presente invenzione si riferisce ad una miscela probiotica comprendente, o costituita da, le seguenti specie probiotiche: Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus.
In una forma di realizzazione, la presente invenzione si riferisce ad una miscela probiotica comprendente, o costituita da, almeno un ceppo di ognuna delle seguenti specie probiotiche: Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus.
In una forma di realizzazione preferita, la miscela probiotica comprende Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus quali unici microorganismi o componenti attivi nella prevenzione e/o nel trattamento di affezioni intestinali.
In particolare, tali affezioni intestinali possono essere, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, causate da alterazione della flora batterica intestinale in generale. Tale alterazione può essere una generica alterazione della flora batterica intestinale di un individuo anche nota come disbiosi intestinale, o può essere anche aggravata o causata da infezioni da microorganismi patogeni, come ad esempio infezioni da C. difficile.
La miscela dell’invenzione quindi, può consistere nell’associazione di uno o più ceppi dei batteri sopra elencati, oppure può comprendere altri composti (attivi e non) a condizione che detti composti non siano principi o composti attivi nella prevenzione e/o nel trattamento di affezioni intestinali, quali, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, ad esempio quelle da C. difficile, o la disbiosi intestinale.
Tali composti possono essere ad esempio principi attivi farmaceutici per il trattamento di patologie associate, o possono essere uno o più prebiotici che favoriscono la colonizzazione della mucosa intestinale da parte dei batteri probiotici presenti nella miscela.
Di seguito, sono brevemente descritti i probiotici selezionati dagli autori della presente invenzione.
I bifidobatteri sono bacilli Gram-positivi pleomorfi, asporigeni, anaerobi, appartenenti al Phylum Actinobacteria. Il genere Bifidobacterium è il principale colonizzatore dell’uomo ed è riconosciuta una sua notevole importanza fin dalla nascita. Bifidobacterium bifidum, Bifidobacterium breve e Bifidobacterium longum sono i principali colonizzatori degli infanti e, progressivamente negli anni, i primi due si riducono dando spazio alla proliferazione di B. catenulatum e B. adolescentis, ma permane la presenza di B. longum. È verosimile che questo cambiamento avvenga per la modificazione di abitudini alimentari ed ambientali.
La capacità dei bifidobatteri di stimolare il sistema immunitario è talmente dimostrata, soprattutto quella nei neonati di bilanciare il rapporto T-helper 1(TH1)/TH2, che il loro utilizzo è ampiamente diffuso nella prevenzione di malattie intestinali, diarree finanche necrotizzanti o malattie sistemiche come allergie, morbo celiaco, obesità. Inoltre è comprovata la loro efficacia. I principali stimolatori del sistema immunitario sono B. bifidum e B. longum.
Il Bacillus subtilis, Phylum Firmicutes, è un microrganismo Gram positivo anaerobio sporigeno. La sua spora ha le stesse peculiarità del C.difficile pur differendo per il 75% in contenuto proteico. Per questa sua caratteristica riesce a sopravvivere al pH gastrico e raggiungere anche l’intestino crasso. Inoltre è riconosciuto avere effetti positivi attraverso la produzione di aminoacidi enzimi e componenti antimicrobiche come le batteriocine, con notevoli effetti su entero- patogeni Gram + e Gram -. In particolare, B.subtilis ha un notevole effetto stimolante sul tessuto linfoide intestinale (Gut-Associated Lymphoid Tissue – GALT). Altra caratteristica positiva è che B. subtilis, utilizzato come probiotico, aderisce alle cellule intestinali e, attraverso un meccanismo di competizione ambientale, combatte patogeni intestinali.
I lattobacilli sono batteri Gram positivi aerobi, anaerobi facoltativi appartenenti al Phylum Firmicutes. Il genere Lactobacillus è importante per il mantenimento della stabilità del tratto gastrointestinale, prevenendo le infezioni intestinali e interagendo con le cellule epiteliali dell’intestino. Sono normalmente veicolati da latte e da prodotti caseari. Per questo motivo è da tempo nota la loro non patogenicità e la loro peculiarità di resistere all’azione della bile. Inoltre Lactobacillus spp. producono sostanze battericide quali batteriocine, perossido d’idrogeno ed acidi organici, che controllano la crescita di batteri patogeni, sia Gram positivi che Gram negativi.
La dimostrata attività benefica di questi probiotici e la loro adattabilità a diverse sostanze alimentari hanno contribuito ad inserirli in diversi veicoli oltre al latte, quali succhi di frutta o estratti di pomodoro, indicati quali integratori nelle diete vegane. In particolare: Lactobacillus rhamnosus riequilibra bifidobacteria autoctoni, riduce lo stato infiammatorio attraverso la produzione della proteina P40; inibisce l’apoptosi intestinale, è in grado di stimolare citochine (interleuchine, Interferon gamma,Tumor Necrosis Factor) e produce biofilm protettivo; Lactobacillus casei produce Vitamina B-12; Lactobacillus gasseri è tra i più isolati da feci umane.
L’Enterococcus faecium è un cocco Gram positivo appartenente al Phylum dei Firmicutes. Il suo uso come probiotico è particolarmente collegato all’azione anti-diarrea infettiva ed antibiotico correlata. E. faecium è un commensale del tratto intestinale e questo fattore sembra influenzare positivamente la sua azione così come il fatto di avere una rapida adattabilità all’ambiente (lag-phase) e ridotta replicazione. Dimostrata è la sua inibizione sulla crescita di enteropatogeni come Escherichia coli, Salmonella serovars, Shigella spp. e Enterobacter spp., come per gli altri probiotici, è resistente a pH acido ed alla bile.
Al fine di garantire la sicurezza del ceppo probiotico, devono essere considerati i parametri IS16, hylEfm, esp, sequenza genomica completa e MIC (Minimum Inhibitory Concentration) a vari antibiotici, inclusa l’ampicillina, (Antimicrobial Resistance – AMR).
Streptococcus thermophilus, cocco Gram positivo appartenente al Phylum dei Firmicutes, è uno dei principali batteri omofermentativi termofili, ampiamente utilizzato nell’industria casearia. Produce un esopolisaccaride che ha proprietà probiotiche dimostrate anti-infiammatorie tali da indirizzare il suo studio verso lo sviluppo ed utilizzo come antiossidante e anticancerogeno.
In una forma di realizzazione, la miscela può comprendere uno specifico ceppo di ciascuna delle diverse specie probiotiche che compongono la miscela suddetta.
Tuttavia, per lo scopo della presente invenzione, può essere impiegato qualunque ceppo noto di ciascuna delle specie probiotiche che compongono la miscela secondo qualunque delle forme di realizzazione qui descritte. Inoltre, tutte le specie e i ceppi selezionati sono reperibili in commercio e comunque isolabili secondo le tecniche note all’esperto dell’arte.
A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Bifidobacterium bifidum codice ceppo BBF210 (BBF055) EU COLLECTION LMG P-29508 (DSM25565) ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Bifidobacterium breve codice ceppo PBS077 EU COLLECTION (DSM25173) ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Bifidobacterium longum codice ceppo BLG240 (PBS108) EU COLLECTION LMG P-29511 (DSM25174) ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Bacillus subtilis codice ceppo SNZ-1972 Azienda Chimica e Farmaceutica. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Lactobacillus casei codice ceppo LC010 EU COLLECTION (DSM25569) ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Lactobacillus gasseri codice ceppo LG050 EU COLLECTION LMG P-29638 ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Lactobacillus rhamnosus codice ceppo LRH020 EUCOLLECTION LMG P-29513 (DSM25568) ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Enterococcus faecium codice ceppo LMG S-28935 EUCOLLECTION LMG P- 21906 ROELMI-HPC. A solo scopo esemplificativo, ma in alcun modo limitativo, la miscela può comprendere Streptococcus thermofilus codice ceppo ST075 EUCOLLECTION (DSM26721) ROELMI-HPC.
In una forma di realizzazione, la presente invenzione si riferisce ad una miscela probiotica comprendente, o costituita da, almeno uno dei seguenti ceppi batterici: Bifidobacterium bifidum BBF210 (BBF055), Bifidobacterium breve PBS077, Bifidobacterium longum BLG240, Bacillus subtilis SNZ-1972, Lactobacillus casei LC010, Lactobacillus gasseri LG050, Lactobacillus rhamnosus LRH020, Enterococcus faecium LMG S-28935 e Streptococcus thermofilus ST075.
Seppur non si tratti di una caratteristica essenziale ai fini dell’effetto terapeutico, gli inventori della presente invenzione hanno sorprendentemente trovato che, quando nella miscela probiotica i batteri aerobi-anaerobi facoltativi (Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus) sono presenti circa al 40 ± 5% e i batteri anaerobi (Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis,) sono presenti circa al 60 ± 5%, delle unità formanti colonia totali per grammo (ufc x g) della miscela probiotica, la miscela probiotica della presente invenzione è in grado di esplicare i suoi effetti benefici in maniera ottimale. Questo perché, pur non volendo essere legati ad alcuna teoria particolare, il microbiota intestinale fisiologico è costituito prevalentemente da batteri anaerobi.
Pertanto, in una forma di realizzazione preferita, nella miscela della presente invenzione il 40 ± 5% è rappresentato da batteri aerobi-anaerobi facoltativi (Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus) e il 60% ± 5% da batteri anaerobi (Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus).
Le diverse specie probiotiche che caratterizzano la miscela della presente invenzione possono essere presenti in quantità variabile.
Tuttavia, gli inventori hanno anche trovato che quando nella miscela della presente invenzione i probiotici del genere Bifidobacterium (gruppo 1: Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum) sono complessivamente presenti al 50 ± 5%, i probiotici del genere Lactobacillus (gruppo 2: Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus) sono complessivamente presenti al 16,5% ± 5%, i probiotici Enterococcus faecium e Streptococcus thermofilus (gruppo 3) sono complessivamente presenti al 23,5% ± 5% e il probiotico Bacillus subtilis è presente al 10% ± 5% delle unità formanti colonia totali per grammo (ufc x g) della miscela probiotica, le singole specie che compongono ciascun gruppo sono in grado di compensarsi l’un l’altra indipendentemente dalla loro quantità. Ciò significa che, in una forma di realizzazione, la concentrazione delle singole specie di ciascun gruppo può essere liberamente variata a condizione che siano mantenute le concentrazioni complessive dei gruppi come sopra definite.
Pertanto, la presente invenzione si riferisce anche ad una miscela probiotica comprendente, o costituita da, il 50% ± 5% di probiotici del genere Bifidobacterium, il 16,5% ± 5% di probiotici del genere Lactobacillus, il 23,5% ± 5% di Enterococcus faecium e Streptococcus thermofilus e il 10% ± 5% di Bacillus subtilis delle unità formanti colonia totali per grammo (ufc x g) della miscela probiotica.
In altre parole, secondo una forma di realizzazione della presente invenzione, nella miscela probiotica i probiotici del genere Bifidobacterium sono presenti al 50% ± 5%, i probiotici del genere Lactobacillus sono presenti al 16,5% ± 5%, Enterococcus faecium e Streptococcus thermofilus sono complessivamente presenti al 23,5% ± 5% e Bacillus subtilis è presente al 10% ± 5% delle unità formanti colonia totali per grammo (ufc x g) della miscela probiotica.
Tabella 1: esempi di variabilità di dose delle singole specie probiotiche all’interno di ciascun gruppo.
Probiotico | dose elettiva (%) | dose variabile1 (%) | dose variabile 2 (%) | |
Gruppo 1 | Bifidobacterium bifidum | 13,03 | 13,5 | 12 |
Bifidobacterium breve | 12,3 | 13,2 | 13,1 | |
Bifidobacterium longum | 24,19 | 23 | 24,6 | |
Sub totale | 49,52 | 49,7 | 49,7 |
Gruppo 2 | Lactobacillus casei | 6,1 | 5,2 | 6,8 |
Lactobacillus gasseri | 4,1 | 4,2 | 3,9 | |
Lactobacillus rhamnosus | 6,1 | 6,9 | 6,5 | |
Sub totale | 16,3 | 16,3 | 17,2 | |
Gruppo 3 | Enterococcus faecium | 12,04 | 11,4 | 11,5 |
Streptococcus thermophilus | 12,04 | 12,5 | 12 | |
Sub totale | 24,08 | 23,9 | 23,5 | |
Bacillus subtilis | 10,1 | 10,1 | 9,6 | |
Totale | 100 | 100 | 100 |
Inoltre, gli inventori hanno anche individuato intervalli di concentrazione entro cui ciascuna di dette specie probiotiche esplica la sua azione benefica in maniera più vantaggiosa.
In particolare, Bifidobacterium bifidum può essere presente nella miscela al 12%-14%, preferibilmente al 13,03% delle unità formanti colonia totali della miscela probiotica. Bifidobacterium breve, può essere presente nella miscela all’11,6%-13,2%, preferibilmente al 12,3% delle unità formanti colonia totali della miscela probiotica. Bifidobacterium longum può essere presente nella miscela al 22,8%-25,5%, preferibilmente al 24,19% delle unità formanti colonia totali della miscela probiotica. Bacillus subtilis può essere presente nella miscela al 9,6%- 10,7%, preferibilmente al 10,1% delle unità formanti colonia totali della miscela probiotica. Lactobacillus casei può essere presente nella miscela al 5,2%-6,9%, preferibilmente al 6,1% delle unità formanti colonia totali della miscela probiotica.
Lactobacillus gasseri può essere presente nella miscela al 3,9%-4,2%, preferibilmente al 4,1% delle unità formanti colonia totali della miscela probiotica. Lactobacillus rhamnosus può essere presente nella miscela al 5,2%-6,9%, preferibilmente al 6,1% delle unità formanti colonia totali della miscela probiotica. Enterococcus faecium può essere presente nella miscela al 11,4%-12,5%, preferibilmente al 12,04% delle unità formanti colonia totali della miscela probiotica. Streptococcus thermofilus può essere presente nella miscela all’11,4%- 12,5%, preferibilmente al 12,04% delle unità formanti colonia totali della miscela probiotica.
In una forma di realizzazione particolarmente preferita, la miscela probiotica della presente invenzione può comprendere Bifidobacterium bifidum al 13,03%, Bifidobacterium breve al 12,3%, Bifidobacterium longum al 24,19%, Bacillus subtilis al 10,1%, Lactobacillus casei al 6,1%, Lactobacillus gasseri al 4,1%, Lactobacillus rhamnosus al 6,1%, Enterococcus faecium al 12,04% e Streptococcus thermofilus al 12,04% delle unità formanti colonia totali della miscela probiotica (vedere, Tabella 2 di seguito riportata).
La quantità efficace di unità formanti colonia (ufc) di ciascun probiotico della miscela dell’invenzione può variare a seconda della formulazione finale.
In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 2,36 x 1010 ufc/g ± 1,4 x 109 ufc/g di Bifidobacterium bifidum. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 2,23 x 1010 ufc/g ± 1,4 x 109 ufc/g di Bifidobacterium breve. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 4,38 x 1010 ufc/g ± 2,4 x 109 ufc/g di Bifidobacterium longum. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 1,84 x 1010 ufc/g ± 1 x 109 ufc/g di Bacillus subtilis. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 1,1 x 1010 ufc/g ± 1,5 x 109 ufc/g di Lactobacillus casei. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 7,4 x 1010 ufc/g ± 3 x 108 ufc/g di Lactobacillus gasseri. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 1,1 x 1010 ufc/g ± 1,5 x 109 ufc/g di Lactobacillus rhamnosus. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 2,18 x 1010 ufc/g ± 1 x 109 ufc/g di Enterococcus faecium. In una forma di realizzazione, la miscela della presente invenzione comprende preferibilmente 2,18 x 1010 ufc/g ± 1 x 109 ufc/g di Streptococcus thermofilus.
In un’altra forma di realizzazione, la miscela della presente invenzione comprende 2,36 x 1010 ufc/g ± 1,4 x 109 ufc/g di Bifidobacterium bifidum, 2,23 x 1010 ufc/g ± 1,4 x 109 ufc/g di Bifidobacterium breve, 4,38 x 1010 ufc/g ± 2,4 x 109 ufc/g di Bifidobacterium longum, 1,84 x 1010 ufc/g ± 1 x 109 ufc/g di Bacillus subtilis, 1,1 x 1010 ufc/g ± 1,5 x 109 ufc/g di Lactobacillus casei, 7,4 x 1010 ufc/g ± 3 x 108 ufc/g di Lactobacillus gasseri, 1,1 x 1010 ufc/g ±1.5 x 109 ufc/g di Lactobacillus rhamnosus, 2,18 x 1010 ufc/g ± 1 x 109 ufc/g di Enterococcus faecium e 2,18 x 1010 ufc/g ±1 x 109 ufc/g di Streptococcus thermofilus.
In una forma di realizzazione dell’invenzione, la miscela della presente invenzione è come riportato nella tabella seguente (Tabella 2).
Tabella 2: Miscela dei Probiotici selezionati
Probiotico | ufc/g | % |
Bifidobacterium bifidum | 2,36 x 1010 ufc/g | 13,03% |
Bifidobacterium breve | 2,23 x 1010 ufc/g | 12,3% |
Bifidobacterium longum | 4,38 x 1010 ufc/g | 24,19% |
Bacillus subtilis | 1,84 x 1010 ufc/g | 10,1% |
Lactobacillus casei | 1,1 x 1010 ufc/g | 6,1% |
Lactobacillus gasseri | 7,4 x 109 ufc/g | 4,1% |
Lactobacillus rhamnosus | 1,1 x 1010 ufc/g | 6,1% |
Enterococcus faecium | 2,18 x 1010 ufc/g | 12,04 % |
Streptococcus thermophilus | 2,18 x 1010 ufc/g | 12,04% |
totale | 1,81 x 1011 ufc/g | 100% |
*ufc/g: unità formanti colonia per grammo
La presente invenzione si riferisce anche ad una composizione comprendente la miscela probiotica come descritta sopra.
Pertanto, la presente invenzione si riferisce anche ad una composizione comprendente una miscela probiotica di Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus secondo qualsiasi delle forme di realizzazione esemplificate sopra, e almeno un eccipiente e/o additivo adatto.
Più in particolare, la composizione può comprendere una miscela probiotica di: Bifidobacterium bifidum BBF210 (BBF055), Bifidobacterium breve PBS077, Bifidobacterium longum BLG240, Bacillus subtilis SNZ-1972, Lactobacillus casei LC010, Lactobacillus gasseri LG050, Lactobacillus rhamnosus LRH020, Enterococcus faecium LMG S-28935, Streptococcus thermofilus ST075 e almeno un eccipiente e/o additivo adatto.
Detto eccipiente e/o additivo adatto può essere un eccipiente farmaceuticamente accettabile, e può essere scelto, ad esempio, fra quelli generalmente noti nello stato dell’arte e include, ma non è ad esso limitato: veicolanti, riempitivi, umettanti, agenti disintegranti, leganti, agenti ritardanti, acceleratori dell’assorbimento, agenti bagnanti, tensioattivi, adsorbenti, lubrificanti, glidanti, aromi, dolcificanti e/o conservanti.
L’esperto del settore saprà selezionare opportuni additivi/eccipienti dalla conoscenza generale nel settore.
Per la realizzazione dell’invenzione possono quindi essere utilizzati opportuni veicolanti come ad esempio citrato di sodio e calcio fosfato. Come riempitivi possono ad esempio essere utilizzati, senza tuttavia limitarsi agli esempi
forniti, amido, lattosio, cellulosa microcristallina, saccarosio, glucosio, mannitolo, trigliceridi e silice colloidale. Umettanti idonei alla realizzazione dell’invenzione possono essere, ad esempio, glicerolo o altri umettanti comunemente utilizzati. Un esempio non limitante di agenti disintegranti è dato da alginati, carbonato di calcio, amidi, derivati dell’amido, della cellulosa e del polivinilpirrolidone, silicati e carbonato di sodio. Tra i possibili leganti idonei vi sono, senza tuttavia essere ad essi limitati, carbossimetilcellulosa, alginati, gelatina, polivinilpirrolidone, saccarosio, derivati polimerici della cellulosa, derivati dell’amido. Agenti ritardanti atti alla realizzazione della composizione dell’invenzione sono, ad esempio, paraffina, polimeri della cellulosa, esteri degli acidi grassi e simili. Opportuni acceleratori dell’assorbimento possono essere ad esempio composti di ammonio quaternario. Tra gli agenti bagnanti e tensioattivi atti alla realizzazione della composizione dell’invenzione vi sono, ad esempio, alcool cetilico e glicerolo monostearato. Un esempio non limitante di adsorbenti comprende argille bentoniche e caolino. Lubrificanti comunemente utilizzati nel settore sono rappresentati, ad esempio, da talco, stearato di calcio, stearato di magnesio, glicol polietilenico, sodio lauril solfato, sodio stearilfumarato. Opportuni glidanti possono essere talco, silice colloidale. Possono essere utilizzati aromi qualora ritenuto necessario o quando la formulazione lo prevede. Dolcificanti convenzionali sono rappresentati da saccarosio, fruttosio, xilitolo, mannitolo, sorbitolo, stevioside, ecc. Infine, come conservanti si possono, ad esempio, utilizzare benzoati, nitriti, solfati e sorbati.
Le composizioni secondo qualsiasi delle forme di realizzazione fornite nella presente descrizione, possono essere formulate in qualsiasi forma, somministrate per qualunque via di somministrazione ed associate a qualsiasi altro componente, in una varietà di modi. Le composizioni sono preferibilmente, ma non esclusivamente, somministrate per via orale.
Le composizioni possono essere in forma liquida, semiliquida, solida o semisolida. Forme liquide adatte ad una somministrazione orale sono, a titolo esemplificativo, gocce, emulsioni, soluzioni, sospensioni (preparate o estemporanee), sciroppi ed elisir. In una forma di realizzazione preferita, le composizioni sono formulazioni solide quali, ad esempio, compresse, capsule rigide o molli, pillole, gelatine, pastiglie, polveri, granulati, bustine e film. Le formulazioni liquide o semiliquide potranno essere contenute in opportuni vettori di somministrazione.
Le forme di dosaggio solide, quali compresse, capsule rigide o molli, gelatine, pillole, pastiglie, polveri, granulati, bustine e film, possono anche essere rivestite con rivestimenti enterici, gastrici o di altro tipo noti nello stato dell’arte. Esse possono essere del tipo da permettere il rilascio degli ingredienti attivi soltanto o preferibilmente in un certo tratto dell’intestino, eventualmente, in modo ritardato. Sostanze che possono permettere tale uso ritardato includono, ma non sono limitate a, polimeri e cere. In una forma di realizzazione preferita, la composizione è formulata in forma di compressa o capsula. In una forma di realizzazione particolarmente preferita, la composizione è formulata in forma di compressa o capsula gastroresistente secondo la composizione quali-quantitativa riportata in Tabella 3.
Tabella 3: unità formanti colonia per capsula di ciascuno dei probiotici selezionati.
Probiotico (ufc/g dei prodotti utilizzati) | ufc/capsula | mg/dose |
Bifidobacterium bifidum 250mld | 5,9×109 | 23,6 |
Bifidobacterium breve 300mld | 5,6×109 | 18,58 |
Bifidobacterium longum 100mld | 10,9 x109 | 109,5 |
Bacillus subtilis 100mld | 4,6 x109 | 46 |
Lactobacillus casei 300mld | 2,75 x109 | 9,17 |
Lactobacillus gasseri 200mld | 1,85 x108 | 9,68 |
Lactobacillus rhamnosus 300mld | 2,75 x109 | 9,17 |
Enterococcus faecium 500mld | 5,4 x109 | 10,9 |
Streptococcus thermophilus 200mld | 5,4 x109 | 27,5 |
Eccipienti | mg/dose | |
inulina | 136,15 | |
sali di magnesio acidi grassi | 5 | |
capsula gastroresistente dr | 95 | |
TOTALE | 500 |
*I probiotici utilizzati hanno una resa specifica per grammo che può variare da produttore a produttore. Pertanto, fa fede la quantizzazione in ufc/capsula e non mg/dose.
Le formulazioni, secondo qualunque delle forme di realizzazione qui descritte, possono essere preparate secondo metodi convenzionali noti all’esperto della tecnica. Ad esempio, per la preparazione della capsula di cui sopra potranno essere miscelati i probiotici selezionati e aggiunti eccipienti convenzionali fino a volume della capsula, dove gli eccipienti convenzionali sono come definito sopra.
Inoltre, in accordo a qualsiasi delle forme di realizzazione, la miscela o la composizione della presente invenzione sono principalmente destinate ad essere utilizzati dagli umani, ma possono anche essere utilizzate sugli animali.
La presente invenzione si riferisce anche ad una miscela probiotica comprendente, o costituita da, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus per l’uso come medicamento.
In particolare, la presente invenzione si riferisce anche ad una miscela probiotica comprendente, o costituita da, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus per l’uso nella prevenzione e/o nel trattamento di affezioni intestinali quali, a titolo esemplificativo, le diarree infettive e antibiotico-terapia associate, ad esempio quelle da C. difficile, o la disbiosi intestinale.
Ancora più in particolare, la presente invenzione si riferisce ad una miscela probiotica comprendete, o costituita da, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus per l’uso nella prevenzione e/o nel trattamento di diarrea da C. difficile. La presente invenzione si riferisce anche ad una composizione comprendente una miscela probiotica di Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus per l’uso come medicamento.
In particolare, la presente invenzione si riferisce anche ad una composizione comprendente una miscela probiotica di Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus per l’uso nella prevenzione e/o nel trattamento di affezioni intestinali quali, a titolo esemplificativo, le diarree infettive e antibiotico- terapia associate, ad esempio quelle da C. difficile, e quindi la disbiosi intestinale associata.
Ancora più in particolare, la presente invenzione si riferisce ad una composizione comprendente una miscela probiotica di Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus per l’uso nella prevenzione e/o nel trattamento di diarrea da C. difficile e diarrea antibiotico-associata.
La presente invenzione si riferisce anche ad un prodotto alimentare comprendente la miscela probiotica come descritta sopra. Detto prodotto alimentare può essere, ad esempio, un integratore alimentare, una bevanda, un nutraceutico, un alimento, oppure un alimento funzionale o medicato. Ancora più in particolare, il prodotto alimentare, comprendente la miscela probiotica dell’invenzione, può essere uno yogurt, un succo, un frullato, un estratto, una centrifuga, una barretta, una gelatina o simili.
Pertanto, la presente invenzione si riferisce anche ad un prodotto alimentare, sia esso un integratore alimentare, una bevanda, un nutraceutico, un alimento, un alimento funzionale o medicato, comprendente la miscela probiotica di Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus e almeno un eccipiente e/o additivo adatto, dove l’eccipiente e l’additivo adatto sono come definiti sopra.
I vantaggi della miscela probiotica della presente invenzione, e quindi di composizioni o prodotti che la contengono, rispetto al trapianto fecale e/o alle altre composizioni probiotiche note nell’arte risulteranno evidenti all’esperto della tecnica. In particolare, rispetto al trapianto fecale, non c‘è più la necessità di selezionare un donatore con le relative problematiche di reperimento dello stesso e dei costi elevati; non è necessario il ricovero in ambiente ospedaliero né l’utilizzo di presidi medici; non è necessario un laboratorio per la preparazione dell’infusione; maggior sicurezza perché si utilizzano batteri validati e certificati; si può assumere per via orale ed è dunque fruibile a tutti i tipi di pazienti, ospedalizzati e non. Inoltre, rispetto alle altre composizioni probiotiche note nell’arte garantisce maggior riproducibilità nella prevenzione e/o nel trattamento delle affezioni intestinali.
Altri vantaggi della miscela probiotica di cui alla presente invenzione saranno immediatamente evidenti all’esperto della tecnica sulla base della precedente descrizione e degli esempi di seguito riportati.
ESEMPI
Gli esempi di seguito riportati sono solo a scopo illustrativo e non sono intesi limitare la portata della presente invenzione. Variazioni e modifiche di qualunque delle forme di realizzazione qui descritte, che risultano ovvie ad un esperto della tecnica, sono ricomprese nello scopo delle rivendicazioni annesse.
Esempio 1: valutazione della carica microbica in soluzione di feci di donatori sani di microbiota per infusione fecale.
Sono state effettuate circa 300 infusioni di microbiota intestinale in pazienti affetti da CDI, proveniente da donatori sani. La preparazione in laboratorio consiste nell’ottenere una soluzione di microbiota fecale attraverso diversi passaggi di lavaggio e filtrazioni. È stato quantificato il numero di batteri presenti nelle soluzioni e abbiamo ottenuto concentrazioni batteriche non costanti, proprio per le variabili che possono esserci nella preparazione dell’infusione. Quindi il valore medio di batteri ottenuto è stato di 1,7 x 1010 UFC/ g di feci.
Sono state quantificate 20 soluzioni per infusione fecale. Partendo da 1 ml di soluzione sono state effettuate 9 diluizioni seriali 1 a 10 fino alla 10-9. La diluizione 10-9 è stata posta in coltura utilizzando un’ansa calibrata da 10 µl, dove sono state rilevate le colonie di batteri (UFC) cresciute.
A questo punto è stata utilizzata la seguente formula:
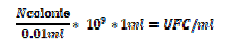
Quindi utilizzando le formule
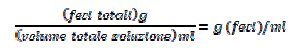
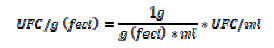
abbiamo ottenuto le UFC/g di feci.
Esempio 2: valutazione della percentuale di phyla in donatori sani e riceventi.
Mediante analisi di pirosequenziamento, è stato possibile individuare come i donatori di feci per trapianto fecale siano corredati a livello di Phylum di un microbiota intestinale caratteristico. Infatti è presente una parte maggioritaria di 25 Firmicutes (45%-80%) e minoritaria di Proteobacteria (1-4%). I riceventi affetti da CDI presentano invece un profilo microbiotico invertito Proteobacteria (50%-80%) e Firmicutes (10%-19%).
Dopo infusione di microbiota intestinale del donatore, i microbiota dei pazienti affetti da CDI hanno mostrato una ripresa del profilo verso la riacquisizione di una giusta proporzione di Firmicutes (FIG. 1). Pertanto, è stato possibile verificare che infusioni per via colonscopica della miscela di probiotici dell’invenzione hanno avuto successo risolutivo in pazienti affetti da CDI.
Esempio comparativo 3: Comparazione dell’efficacia della miscela di nove probiotici dell’invenzione rispetto ad altre miscele.
La miscela dei 9 probiotici dell’invenzione è stata testata per il trattamento dell’infezione da C. difficile, attraverso la somministrazione per via colonscopica, in comparazione con la miscela di 15 ceppi batterici (Acidaminococcus intestinii, Alistipes finegoldii, Bacteroides fragilis, Bacteroides ovatus, Bacteroides uniformis, Bifidobacterium longum, Clostridium scindens, Escherichia coli, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Lactobacillus parabuchnerii, Parabacteroides distasonis, Propionibacterium avidum, Ruminococcus gnavus) in precedenza sperimentati. Sono stati trattati sei pazienti, tre con la miscela di 15 ceppi batterici e tre con la miscela di 9 ceppi batterici.
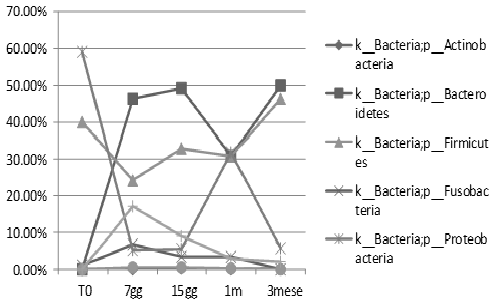
Mediante pirosequenziamento è stato possibile verificare due pazienti trattati con la formulazione dei 15 ceppi batterici. In FIG. 2 il grafico mostra l’andamento temporale dei Phyla relativi al paziente 1. Prima di ricevere l’infusione (T0) il paziente possedeva un microbiota intestinale a favore del Phylum Bacteroidetes (72%). I Firmicutes ed i Proteobacteria erano presenti con un’abbondanza relativa rispettivamente del 12% e 10%. I Verrucomicrobia erano presenti per lo 0,01%. Al tempo T1 (7 giorni) il livello di Bacteroidetes si riduce al 47% con un aumento di Firmicutes al 23% e Verrucomicrobia al 22%. Nei follow- up successivi si evidenzia un mantenimento dell’equilibrio del microbiota intestinale.
Nel paziente 2 (FIG. 3) a T0 la popolazione batterica intestinale si presentava costituita da Proteobacteria (60%), Firmicutes (40%) ed una riduzione del Phylum Bacteroidetes (0,05%) e Verrucomicrobia (0,02%). Nei successivi follow-up Proteobacteria raggiungono il 5%, mentre Phylum Bacteroidetes raggiunge il 50% e Verrucomicrobia 17%. Al terzo mese dopo l’infusione il microbiota sembra essere stabile.
Da un punto di vista clinico è stata ottenuta la risoluzione della diarrea e una negativizzazione delle tossine A/B di C.difficile in tutti i pazienti arruolati.
Esempio 3: valutazione della efficacia della miscela probiotica per via orale.
Il protocollo del trial clinico sperimentale prevede la somministrazione della miscela dei 9 ceppi batterici attraverso capsule gastroresistenti (due compresse al giorno per due giorni a settimana e per 4 settimane) in pazienti affetti da CDI e diarrea post-terapia antibiotica con braccio di controllo placebo. Al fine di verificare l’efficacia della formulazione probiotica, oltre alla valutazione clinica sono anche analizzati i campioni fecali di pazienti prima del trattamento e a 15 giorni, mendiante Next Generation Sequencing e la ricerca di tossine A/B di C.difficile.
RIVENDICAZIONI
- Miscela probiotica comprendente, o costituita da, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Bacillus subtilis, Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus.
- Miscela probiotica secondo la rivendicazione 1, in cui i batteri aerobi- anaerobi facoltativi (Lactobacillus casei, Lactobacillus gasseri, Lactobacillus rhamnosus, Enterococcus faecium e Streptococcus thermofilus) sono presenti al 40 ± 5% e i batteri anaerobi (Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum e Bacillus subtilis,) sono presenti al 60 ± 5% delle unità formanti colonia totali per grammo (ufc x g) della miscela probiotica.
- Miscela probiotica secondo la rivendicazione 1 o 2, in cui i probiotici del genere Bifidobacterium sono presenti al 50% ± 5%, i probiotici del genere Lactobacillus sono presenti al 16,5% ± 5%, Enterococcus faecium e Streptococcus thermofilus sono complessivamente presenti al 23,5% ± 5% e Bacillus subtilis è presente al 10% ± 5% delle unità formanti colonia totali per grammo (ufc x g) della miscela probiotica.
- Miscela probiotica secondo qualunque delle rivendicazioni da 1 a 3, in cui Bifidobacterium bifidum è presente al 12%-14%, preferibilmente al 13,03%; Bifidobacterium breve è presente all’11,6%-13,1%, preferibilmente al 12,3%; Bifidobacterium longum è presente al 22,8%-25,5%, preferibilmente al 24,19%; Bacillus subtilis è presente al 9,6%-10,7%, preferibilmente al 10,1%; Lactobacillus casei è presente al 5,2%-6,9%, preferibilmente al 6,1%; Lactobacillus gasseri è presente al 3,9%-4,2%, preferibilmente al 4,1%; Lactobacillus rhamnosus è presente al 5,2%-6,9%, preferibilmente al 6,1%; Enterococcus faecium è presente al 11,4%-12,5%, preferibilmente al 12,04 % e Streptococcus thermofilus è presente al 11,4%-12,5%, preferibilmente al 12,04% delle unità formanti colonia totali della miscela probiotica.
- Miscela probiotica secondo qualunque delle rivendicazioni da 1 a 4 per l’uso come medicamento.
- Miscela probiotica per l’uso secondo la rivendicazione 5, per l’uso nella prevenzione e/o nel trattamento di affezioni intestinali preferibilmente scelte tra diarree infettive e antibiotico-terapia associate, preferibilmente da Clostridium difficile, e disbiosi intestinale associata.
- Composizione comprendente la miscela come definita in una qualsiasi delle rivendicazioni da 1 a 4 e almeno un eccipiente e/o additivo adatto.
- Composizione secondo la rivendicazione 7 per uso orale.
- Composizione secondo la rivendicazione 8 in forma solida, semisolida, liquida o semiliquida.
- Composizione secondo la rivendicazione 9 in forma di compressa, capsula rigida o molle, pillola, gelatina, pastiglia, polvere, granulato, bustina, film, gocce, sospensione, emulsione, soluzione, sciroppo o elisir.
- Composizione secondo la rivendicazione 10 in forma di compressa o capsula gastroresistente.
- Composizione secondo una qualsiasi delle rivendicazioni da 7 a 11 per l’uso come medicamento.
- Composizione per l’uso secondo la rivendicazione 12, per l’uso nella prevenzione e/o nel trattamento di affezioni intestinali preferibilmente scelte tra diarree infettive e antibiotico-terapia associate, preferibilmente da Clostridium difficile, e disbiosi intestinale associata.
- Prodotto alimentare scelto tra un integratore alimentare, una bevanda, un nutraceutico, un alimento e un alimento funzionale o medicato comprendente la miscela secondo una qualsiasi delle rivendicazioni da 1 a 4 e almeno un eccipiente e/o additivo adatto.
- Prodotto alimentare secondo la rivendicazione 14 in forma di yogurt, succo, frullato, estratto, centrifuga, barretta o gelatina.
RIASSUNTO
La presente invenzione si riferisce ad una miscela probiotica e al suo nella prevenzione e/o nel trattamento di affezioni intestinali.
1
2
3